trypsinogen
Definition - Vad är Trypsinogen?
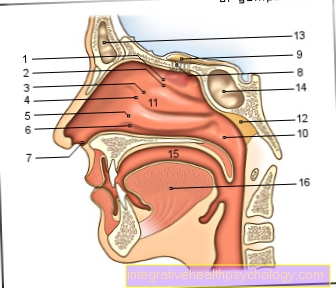
Trypsinogen är den inaktiva föregångaren, en så kallad proenzymet, ett enzym tillverkat i bukspottkörteln, kallat bukspottkörteln. Tillsammans med den återstående bukspottkörtelnutsöndringen, den så kallade bukspottkörteln, frigörs proenzymet trypsinogen via bukspottkörtelkanalerna i tolvfingertarmen, en del av tunntarmen. Det är här aktivering av enzymet trypsin äger rum.
Detta enzym kallas "hydrolas"kategoriserad, det vill säga den kan dela förbindelser mellan enskilda aminosyror. Denna process sker i Tunntarm istället, vilket bryter ner proteinerna som intas genom mat i mindre fragment av aminosyror, vilket gör att de kan tas upp i kroppen.

Hur görs aktivering av trypsin?
Aktiveringen av trypsinogen till trypsin kan ske på två olika sätt. På båda sätten sker inte aktivering i området i bukspottkörteln eller dess kanaler, utan endast i området tolvfingertarmen, en del av tunntarmen.
- Ett annat enzym krävs för en möjlighet att aktivera trypsin. Detta enzym produceras i borstkanten, dvs de ytliga cellerna i tolvfingertarmen. Det heter enteropeptidas eller enterokinas. Enzymet är bland Hydrolaser kategoriserade. Detta innebär att de reversibelt kan klyva föreningarna av enskilda aminosyror, som ger proenzymet trypsinogen sin struktur, genom att konsumera vattenmolekyler. När trypsinogen aktiveras till trypsin, delas en kedja med sex aminosyror, en så kallad hexapeptid, från pro-enzymet trypsinogen medan man konsumerar vatten. Detta skapar en förkortad aminosyrakedja jämfört med tidigare. Processen kallas begränsad proteolys. Emellertid är enzymet nu i sin aktiva form och kan dela upp ytterligare aminosyrakedjor för att kunna bryta ner och smälta proteiner.
- Den andra varianten av att aktivera trypsinogen till trypsin representeras av det redan aktiva enzymet trypsin. Trypsin kan inte bara dela ut främmande proteiner i mindre aminosyrakedjor, utan kan också förkorta kroppens egna proenzym som trypsinogen med flera aminosyror. Trypsin gillar särskilt att dela sig efter den sjätte aminosyran i trypsinogen. Detta innebär att en hexapeptid är uppdelad, vilket omvandlar trypsinogen till sin aktiva form, trypsin. Förutom trypsinogen kan aktivt trypsin omvandla tre andra enzymer som är viktiga för matsmältningen till sin aktiva form. Två faktorer som initialt inte är uppenbara är också viktiga för aktivering. Å ena sidan är effekten av trypsin särskilt god vid ett något basiskt pH-värde på 7 till 8, vilket innebär att trypsinogen alltmer aktiveras. Å andra sidan frisätts trypsinogen i bukspottkörteln med en trypsininhibitor. Detta förhindrar för tidig aktivering i bukspottkörteln och bryts bara ned i tolvfingertarmen.
Var görs trypsinogen?
Proenzymet trypsinogen är grovt formulerat i bukspottkörteln. Det här ligger över övre buken till vänster om magen. Bukspottkörteln kan fortfarande delas upp i två delar:
- Av endokrin del producerar hormoner som insulin för reglering av sockerbalansen, som fungerar i kroppen.
- Av exokrin delsom utgör huvuddelen av bukspottkörteln, producerar bukspottkörteln, som är proenzymet trypsinogen och spelar en viktig roll i matsmältningen.
Du kanske också är intresserad av: Funktioner för bukspottkörteln
Vilka är de normala värdena?
Eftersom trypsinogen normalt passeras genom kanal i bukspottkörteln direkt in i tunntarmen finns det vanligtvis inget trypsinogen i blodet, vilket innebär att de normala värdena närmar sig noll.
Om det är så att trypsinogen upptäcks i blodet talar fyndet definitivt för en patologisk process. Här kommer till exempel en akut pankreatit och Cystisk fibros i fråga. Trypsin testas som en del av den nyfödda screeningen.
Vad har trypsinogen att göra med cystisk fibros?
Vid cystisk fibros, även kallad cystisk fibros, resulterar en mutation i genomet i en förändring av sekretionens sammansättning från körtlar, som frisätter deras utsöndring till ytan av kroppen, såsom tarmen. Utsöndringen blir betydligt mer viskös, vilket innebär att den kan släppas långsammare.
Detta är särskilt kritiskt när det gäller bukspottkörteln. På grund av den längre uppehållstiden i passagen i bukspottkörteln, har utsöndringen en ökad effekt i organet. Eftersom trypsinogen också i allt högre grad aktiveras för trypsin inträffar matsmältningen av den egna kroppen, vilket kan leda till akut pankreatit.
Mer information om ämnet finns här: Cystisk fibros
Vad är trypsin?
Trypsin är ett enzym som härrör från en inaktiv prekursor, pro-enzymet trypsinogen, och spelar en viktig roll i matsmältningen av proteiner. Proenzymet trypsinogen kommer från den exokrina delen av bukspottkörteln. Detta proenzym aktiveras på två olika sätt. Å ena sidan, med hjälp av enzymet enteropeptidas, delas en aminosyrakedja som består av sex aminosyror. Å andra sidan kan trypsin aktivera sig själv. Även här delas en aminosyrakedja som består av sex aminosyror. Aktivt trypsin kan också göra de tre proenzymema Procarboxypeptidases, Proaminopeptidases och kymotrypsinogen konvertera till sina tre aktiva enzymer genom att dela upp en aminosyrakedja. Dessa tre enzymer är också involverade i matsmältningen av proteiner.
Trypsin klassificeras som ett enzym under kategorin Hydrolaser kategoriserade. Detta innebär att de reversibelt kan dela förbindelser mellan aminosyror genom att konsumera vatten. Förmågan att dela upp aminosyrakedjor når maximalt i den något basiska bukspottkörteln med pH-värden mellan 7 och 8. Den här egenskapen är avgörande för matsmältningsprocessen.
Efter enzymerna i saliv i munnen representerar trypsin det andra steget i klyvning av proteiner. Enzymet klyver inte aminosyrakedjan i proteinerna från utsidan, utan delar upp hela kedjan i flera små fragment, som sedan förkortas av andra enzymer så att de är kan absorberas i kroppen genom tarmslemhinnan.
Mer information finns här: Trypsin
Vad händer med en trypsinbrist?
Med brist på trypsin störs matsmältningen av proteiner. I det följande absorberas färre aminosyror i kroppen. Eftersom vissa aminosyror är väsentliga för människokroppen, eftersom de varken kan produceras genom modifiering av befintliga aminosyror eller genom sin egen syntes, uppstår bristsymptom efter en tid, som om de lämnas obehandlade kan få allvarliga konsekvenser.
Dessutom kan det hända att kroppens aminosyrelager, som proteinerna i musklerna, används, vilket leder till viktminskning och minskad motståndskraft.
Alpha-1 antitrypsinbrist
Alpha-1 antitrypsinbrist orsakas ofta av en genetisk defekt. Alpha-1-antitrypsin är ett enzym som hämmar andra enzymer från att fungera. Enzymerna som hämmas i processen har normalt uppgiften att bryta ner proteiner, vilket får dem att förlora sin funktion. Således kan Alpha-1-Antitrypsin också användas som Proteinashämmare är utsedda.
Enzymerna som hämmas av Alpha-1-Antitrypsin förekommer huvudsakligen i inflammatoriska processer och är huvudsakligen Chymotrypsin, trypsin, plasmin, elastas och trombin.
Hämning av elastas är av särskilt vikt här. Som regel bryter elastas elastin, som huvudsakligen finns i lungorna. Elastin är ett strukturellt protein som till stor del ansvarar för lungans elasticitet. Om det saknas elastasinhibitorer såsom alfa-1-antitrypsin, kan detta leda till ökad aktivitet av elastas i lungorna. Här, som överallt i kroppen, bryter elastas ner proteiner, men detta påverkar kroppens egen vävnad i lungorna. Detta leder till massiv skada på lungvävnaden, vilket oundvikligen begränsar lungfunktionen. Bland de symtom som utvecklas från det Hosta, andnöd och en minskning av luftvägarna. Dessutom kan levern, som huvudsakligen är ansvarig för produktion av elastas, uppvisa förhöjda levervärden och skadas ytterligare av gallvägar.
Mer information finns här: Alpha-1 antitrypsinbrist
Rekommendationer från vårt redaktion
- trypsin
- Alpha-1 antitrypsin
- Alpha-1 antitrypsinbrist
- Chymotrypsin - vad är det viktigt för?
- Enzyms roll i människokroppen


.jpg)